Выживание в морозильной камере | Особенность | Мир химии
Жизнь может быть жесткой в ледяных водах Антарктиды. Морская вода опустится до –2 ° C, прежде чем она замерзнет, температура, которая убьет большинство рыб. Все же определенные разновидности приспособились к этим отрицательным температурам. Например, некоторые костистые рыбы счастливо живут в туннелях и ямах, образующихся на плавучих островах морского льда. Выявление химических уловок, которые играют эти рыбы, чтобы снизить температуру замерзания их крови ниже уровня морской воды, оказалось непростой задачей. Теперь мы знаем, что рыба использует небольшое количество высокоактивных антифризных белков.
Поскольку эти белки были впервые обнаружены у антарктических рыб в конце 1960-х годов, было обнаружено, что многие другие виды используют аналогичные соединения, чтобы избежать потенциально фатального образования кристаллов льда в их теле при минусовых температурах. «У рыб это очень мило», - говорит Джон Думан , биолог, который изучает адаптацию к холоду в университете Нотр-Дам в Индиане, США. «Самое холодное, что увидит рыба, это –1,9 ° C - наземные организмы будут видеть намного, намного более холодные температуры». Думан изучал аляскинских жуков, чьи личинки могут иногда выдерживать температуры ниже –100 ° C, и обнаружил сильнодействующие антифризные соединения во флоре и фауне от лягушек до трав.
Несмотря на структурное разнообразие этих соединений, растет количество доказательств того, что все они могут функционировать через общий механизм. В то же время, наконец, достигнут прогресс в применении знаний, полученных при изучении природных антифризов, для практического применения, от замороженных продуктов более высокого качества до криоконсервации тканей или кровоснабжения.
Соленый секрет
Белки антифриза представляют такой потенциальный коммерческий интерес, поскольку они функционируют совершенно иначе, чем типичный антифриз, используемый в настоящее время, например, для защиты автомобильных двигателей. Полиэтиленгликоль и тому подобное снижают температуру замерзания воды благодаря коллигативным эффектам: добавление любого растворенного вещества в воду повышает ее энтропию, понижая точку, в которой он замерзает. Растворенные соли имеют тот же эффект, поэтому морская вода имеет температуру замерзания около –2 ° C.
В 1960-х годах исследователи, которые охотились сквозь кровь антарктических рыб и пытались определить соединения, которые могли бы объяснить пониженную точку замерзания, предположили, что должны быть задействованы коллигативные эффекты. «Когда люди впервые попытались понять, что делают полярные рыбы, они искали полиолы и низкомолекулярные антифризы», - вспоминает Думан. «Они знали свою физическую химию и знали, что белок не будет важен, потому что вы не можете получить его достаточно в раствор, чтобы снизить коллигативную точку замерзания». И все же выделенные соединения никогда не могли полностью объяснить тот факт, что кровь костистых рыб оставалась жидкой до температуры ниже –2 ° C.
Артур ДеВрис, биолог из животных, специализирующийся на видах полярных рыб, в конце концов разгадал эту загадку, опубликовав свое открытие в научной статье 1969 года. Основанный в то время в Университете Калифорнии, Дэвис, в США, ДеВрис случайно взглянул на белки в кровь рыбы, и обнаружил необычный глиопротеин в одном из своих экстрактов, который, как он обнаружил, был ответственным за недостающие 30% депрессии точки замерзания у костистых рыб.
Вскоре после своего открытия ДеВрис переехал в Институт океанографии Скриппса, где Думан присоединился к своей исследовательской группе в качестве аспиранта. «На тот момент только одна или две лаборатории работали над антифризными белками», - вспоминает он. Думан начал искать биомолекулы с понижающей температуру замерзания активностью у других полярных рыб, на этот раз в Арктике. Он идентифицировал такой белок у неродственного вида, называемого зимней камбалой, - структура которого сильно отличалась от состава, который DeVries впервые обнаружил у костистых рыб, не в последнюю очередь в том, что в нем отсутствовал какой-либо углеводный компонент. обнаружены другие антифризные белки рыбы, опять же с совершенно другой структурой », - говорит Думан.

Когда Думан начал свою независимую академическую карьеру в Нотр-Дам, он переключил свое внимание на насекомых, избегающих замерзания, которые остаются в центре его исследований сегодня. Одним из широко изученных видов является аляскинский жук, Dendroides canadensis , который производит один из самых мощных известных антифризных белков. «Структура представляет собой 12- или 13-мерные повторяющиеся структуры, где каждый шестой остаток представляет собой цистеин с дисульфидным мостиком, и он производит этот бета-цилиндр с треониновыми группами, очень регулярно расположенными с гидроксильными группами».
Даже в пределах этого единственного вида Думан и его коллеги обнаружили, что жук производит около 30 различных подтипов белка антифриза, каждый из которых явно настроен для наиболее эффективного функционирования в различных областях тела жука, от кишечника до гемолимфы (крови) до эпидермис.
Безбелковый
Со времени открытия Артуром ДеВрисом в 1969 году того, что небольшие количества высокоактивного белка могут защитить полярную рыбу от замерзания, началась гонка по выявлению таких белков у других видов. Возможно, именно поэтому открытие другого небелкового антифриза слишком долгое время.
Джон Думан из Университета Нотр-Дам в Индиане, США, и его коллеги столкнулись с этой проблемой, когда искали антифризные соединения в морозостойком аляскинском жуке под названием Upis ceramboides. 8 'Мы долго пытались очистить белок, но мы не мог - причина была в том, что это был не белок, - говорит Думан. Ответственное соединение на самом деле было гликолипидом.
С тех пор, как это первое открытие, команда идентифицировала антифриз гликолипидов у одного вида растений, шести видов насекомых и лягушки. «Я думаю, что когда люди смотрят вокруг, они обнаруживают, что гликолипиды являются обычным явлением», - говорит Думан. В отличие от белков антифриза, гликолипид, как правило, находится на клеточных мембранах. «Я думаю, что его функция в основном заключается в предотвращении распространения льда через клеточную мембрану», - объясняет Думан. Вместо того, чтобы пытаться вообще избежать замерзания, некоторые виды проявляют морозостойкость: хотя их внеклеточные жидкости замерзают, они применяют различные приспособления - возможно, в том числе гликолипиды - для предотвращения распространения льда через клеточную мембрану для замораживания их внутриклеточных жидкостей, которые могут быть смертельными. ,
Шаблоны в разнообразии
Питер Дэвис биохимик из Университета королевы в Кингстоне, Онтарио, Канада, который изучает структурно-функциональные отношения белков антифриза. «В их структурах есть заметная разница - совершенно ясно, что они развивались в разных королевствах, в разное время, от разных прародителей», - говорит он. «Мы видим все: от простой альфа-спирали до маленьких глобулярных белков и бета-спиралей».
Тем не менее, несмотря на это разнообразие, возникают структурные темы. По словам Дэвиса, белки антифриза, как правило, имеют одно плоское лицо, несколько гидрофобное, часто с очень регулярными повторяющимися структурными мотивами по всей его поверхности. Именно эта поверхность дает белкам их эффекты снижения температуры замерзания, связывая их с поверхностью зарождающихся кристаллов льда и ограничивая дальнейший рост.
Еще в 1971 году DeVries предположил, что антифризные белки должны действовать через связывание льда.4 Эффект становится очевидным при изучении формы кристаллов льда, выращенных в присутствии антифризного белка. Ледяные кристаллы обычно имеют форму трехмерных шестиугольников с шестью плоскостями «призмы» по краю и «базальной» плоскостью сверху и снизу. Белки антифриза рыб связываются с призматическими плоскостями кристаллов льда, блокируя дальнейшие молекулы воды от присоединения кристаллов льда на этих гранях. Вместо этого вода должна прикрепляться к базальной плоскости, что является гораздо более медленным процессом.
Дэвис и его команда провели сайт-направленный мутагенез на различных антифризных белках, чтобы продемонстрировать, что именно их плоское, гидрофобное лицо обеспечивает связывание льда. В настоящее время исследователи приближаются к описанию взаимодействия льда и белка на молекулярном уровне.
«Механизм, который мы считаем действующим для всех этих белков, заключается в том, что они организуют воду в месте связывания льда, и эта связанная вода выглядит очень ледяной», - объясняет Дэвис. Последние теории о границе между льдом и водой предполагают, что ледяные кристаллы имеют квазиджидную воду толщиной в один нанометр, толщиной всего две или три молекулы воды. «Мы считаем, что вода в месте связывания льда очень похожа на этот квазижидкий слой. Я думаю, что они просто сливаются воедино и просто замерзают на льду », - говорит Дэвис.
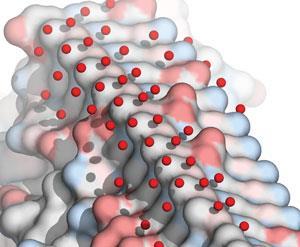
Хотя этот наноразмерный квазиджидкий слой льда невозможно увидеть непосредственно, Дэвис и его команда собрали доказательства этого взаимодействия, объединив кристаллографию белка с вычислительным анализом. «Большим прорывом для нас стало появление кристаллических структур ряда белков, где из-за того, как белок кристаллизовался, они покидают канал растворителя рядом с местом связывания льда», - объясняет Дэвис. В результате нет никаких ограничений на то, как молекулы воды взаимодействуют с этим лицом белка - и результаты довольно ледяные, добавляет Дэвис.
«Другой метод, который становится достаточно надежным, - это молекулярное моделирование», - говорит он. «Поскольку у нас есть кристаллические структуры, мы можем на самом деле проверить наши ответы, и мы находим, что последние программы очень хорошо предсказывают, где вода будет на поверхности белка - это соответствует тому, что мы видим в рентгеновской кристаллической структуре «.
Дэвис говорит, что он хотел бы видеть эту ледяную воду в еще нескольких кристаллических структурах, чтобы быть полностью убежденными в том, что этот способ связывания льда действительно представляет все антифризные белки. К сожалению, антифризные белки очень склонны к кристаллизации с их плоскими, гидрофобными связывающими лед гранями, спрессованными во взаимодействии белок-белок, выдавливая любые молекулы воды. «Одна из вещей, которые мы делаем, - это связать больший белок с антифризным белком и заставить его кристаллизоваться в надежде, что случайно сайт связывания льда окажется в более свободной среде, подверженной воздействию растворителя. Мы видим некоторый прогресс в этом, но это все еще первые дни », - говорит он.
Гладкое мороженое
В течение последнего десятилетия начали появляться первые коммерческие применения антифризных белков. Если вы недавно ели мороженое или фруктовое мороженое Unilever, возможно, оно содержало то, что компания называет «белком, формирующим лед». Идея здесь не в том, чтобы снизить температуру замерзания мороженого, а в том, чтобы использовать еще один аспект свойства льда, связывающего антифриз, - его способность ограничивать размер кристаллов льда. Добавляя небольшое количество белка, можно уменьшить содержание жира в мороженом, не нарушая его гладкую текстуру. Продукты, содержащие белок в форме льда, продавались в таких странах, как США и Австралия, в течение нескольких лет, и в 2009 году компания получила разрешение ЕС на использование ингредиента в мороженом, продаваемом во всех государствах-членах.
«Unilever проделали очень хорошую работу по производству пищевого антифриза с очень низкой стоимостью», - говорит Дэвис. Поскольку белок будет невозможно собрать в дикой природе, компания производит его с использованием генетически модифицированных дрожжей.

По мнению Дэвиса, для некоторых других потенциальных применений именно озабоченность потребителей потреблением ГМ-организмов сдерживает применение антифризов. «Одним из оригинальных приложений, которые мы рассмотрели, был морозостойкий лосось», - говорит он. Идея заключалась бы в добавлении генов антифриза в рыбу или сельскохозяйственные культуры, чтобы их можно было выращивать в течение более длительного сезона или в районах, в настоящее время слишком холодных для их выращивания. «У нас достаточно информации, чтобы сделать лосося с такой же степенью защиты, как у местных рыб в Арктике или Антарктике. Хотел бы я, чтобы рыбоводы шли по этому пути, учитывая степень устойчивости ГМ организмов, я не знаю », - добавляет он.
Для других, столь необходимых применений - например, криоконсервация донорских органов для трансплантации - антифризные белки не доказали успех, на который изначально надеялись. «Если вы попытаетесь сделать с ними криоконсервацию, они нанесут больше вреда, чем защиты», - говорит Мэтью Гибсон химик по полимерам, работающий над антифризными соединениями в Университете Уорика, Великобритания.
Проблема возникает, когда вы пытаетесь разморозить консервированные ткани для использования. «Снаружи тает раньше середины, и на границе раздела довольно много энергии», - объясняет Гибсон. В результате начинается быстрая рекристаллизация льда с очень разрушительными результатами. Благодаря тому, что связанные антифризные белки блокируют рост льда на краях ледяных кристаллов, они начинают расти сверху и снизу, превращаясь в острые игольчатые структуры. «Они пронзают клеточные мембраны и вызывают всевозможные проблемы», - говорит он.
Гибсон и его команда ищут материалы, которые будут препятствовать кристаллизации льда, не понижая точку замерзания и не создавая кристаллы опасной формы. «Мы придерживались мнения, что повторяющийся белок немного похож на полимер. Таким образом, наша гипотеза состояла в том, можем ли мы сделать некоторые синтетические полимеры, чтобы иметь все это свойство, но быть масштабируемыми », - говорит он.
В качестве отправной точки, команда проверила известные полимеры на их антифризные свойства - и наткнулась на довольно маловероятного кандидата6. «Мы обнаружили, что поливиниловый спирт [PVA] - клей для дерева - один из лучших ингибиторов рекристаллизации, который когда-либо был найден» говорит Гибсон. «По цене вы становитесь победителем, и в некоторых странах он одобрен для употребления в пищу», - добавляет он.
Понимание того, почему PVA отображает эти свойства, является актуальной темой исследований в лаборатории Гибсона. «У него нет точной жесткой третичной структуры белков, и мы действительно не знаем, почему это работает. Поскольку полимер становится длиннее, он, кажется, становится лучше, и мы не уверены, почему это так », - говорит он.
Предположение, что размер имеет значение для эффектов ингибирования рекристаллизации ПВС, противоречит работе Роберт Бен в университете Оттавы в Канаде, который использует подход синтетической органической химии для разработки синтетических аналогов антифризных белков. Бен показал, что низкомолекулярное поверхностно-активное вещество, называемое октилгалактопиранозид, и гидрогелатор, называемый октилглюконамид, являются мощными ингибиторами рекристаллизации льда.
Результаты Бена показывают, что его ингибиторы рекристаллизации работают иначе, чем природные антифризные белки. Похоже, что они вообще не связываются со льдом, по-видимому, предотвращая рост кристаллов льда, сидя и нарушая границу между квазижидким слоем воды вокруг кристалла льда и объемной водой.
«Может быть, нет одного механизма, - говорит Гибсон. «Может быть, есть много молекулярных особенностей, которые могут привести к этим свойствам, и только то, что связывающие лед белки делают это одним способом, означает ли это, что это лучшее?»
Джеймс Митчелл Кроу - писатель-исследователь из Мельбурна, Австралия
«Может быть, есть много молекулярных особенностей, которые могут привести к этим свойствам, и только то, что связывающие лед белки делают это одним способом, означает ли это, что это лучшее?